Sécurité alimentaire
Anticorps G12 - Questions fréquemment posées
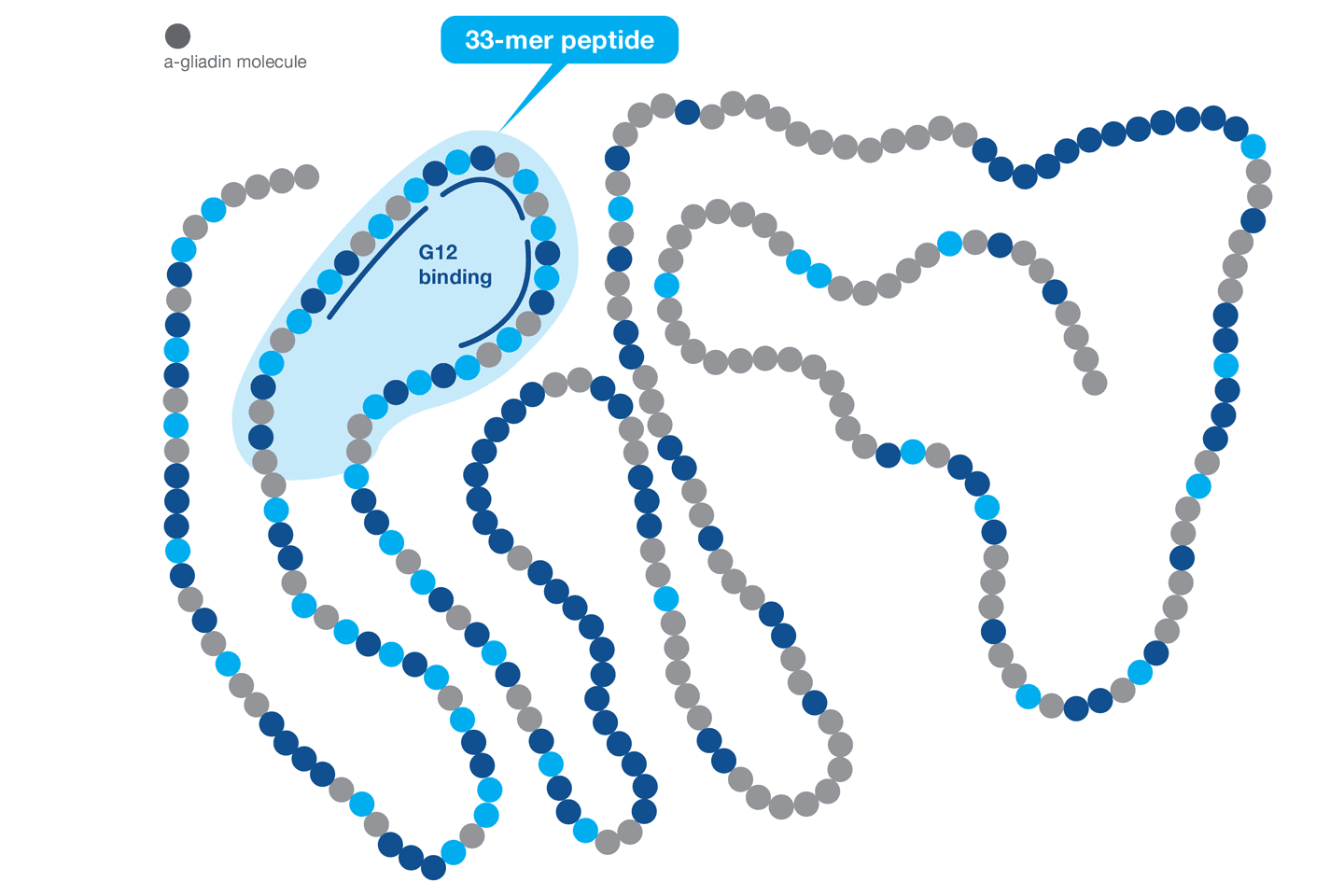
Quelle séquence peptidique l'anticorps G12 reconnaît-il ?
L'anticorps G12 a été soulevé contre le peptide 33-mer hautement immunotoxique de la protéine α-gliadine qui induit la maladie cœliaque (Morón et al., 2008). Plus précisément, la région de reconnaissance à l'intérieur du 33-mer est l'épitope hexamérique QPQLPY. Cette séquence de reconnaissance est répétée trois fois dans le peptide 33-mer de la gliadine. L'anticorps G12 reconnaît les prolamines immunotoxiques du blé, de l'orge, du seigle et de certaines variétés d'avoine (Morón et al., 2008). L'anticorps G12 est également capable de réagir à d'autres épitopes présents dans d'autres prolamines toxiques comme QPQLPF, QPQLPL, QPQQPY, QPQQPF (Morón et al. 2008 ; et Real et al. 2014).
L'anticorps G12 réagit-il uniquement au 33-mer de l'α-gliadine ?
Non, ce n'est pas le cas. L'anticorps G12 peut réagir à des séquences similaires présentes dans d'autres gliadines (oméga, alfa, gamma et bêta) ainsi que dans les gluténines. Le profil de reconnaissance de l'anticorps G12 a été largement caractérisé. (Morón et al., 2008a, Morón et al., 2008b, Real et al., 2014). Il existe d'autres peptides qui pourraient réagir à la G12 et qui sont présents dans les peptides immunogènes du blé, de l'orge et du seigle : QPQLPY, QPQQPY, QPQQPF, QPQLPF, QPQLPL, QPELPY.
Le G12 est-il capable de détecter le gluten dans les bières et autres matières hydrolysées ?
Dans les matières hydrolysées telles que les bières, la proportion relative de peptides réactifs pour les patients cœliaques peut varier, en raison de la diversité des populations de peptides résultant de la fermentation. Dans une publication datant de quelques années (Comino et al., 2012), une grande variété de bières a été analysée avec deux méthodes différentes basées sur l'anticorps G12 (Competitive ELISA et lateral flow immunoassay) avec des résultats similaires. Plus tard (Real et al., 2014), il a été démontré qu'une bière légalement étiquetée comme exempte de gluten (niveau indétectable de gluten par ELISA compétitif R5) contenait des peptides de gluten déterminés par ELISA G12 et par spectrométrie de masse, qui ont identifié des peptides immunotoxiques pour les patients atteints de maladie cœliaque. Ceci a été démontré en exposant les cellules du système immunitaire des patients cœliaques à ces peptides et en mesurant leur réponse. Une étude plus récente (Picariello et al., 2015) a analysé des échantillons de WeissbIer (bière de blé) et a détecté des épitopes immunotoxiques avec G12. Ils ont analysé ces bières avec des sérums de patients cœliaques comme source d'anticorps anti-gliadine, confirmant que la bière de blé contenait des peptides ayant une réactivité avec les sérums de patients cœliaques.
Il existe plus de 1 000 peptides de gluten reconnus comme immunogènes. Le G12 les reconnaît-il tous ?
Détecter tous ces peptides avec un seul anticorps est presque impossible. Cependant, une étude récente (Moreno et al., 2016) a montré que les peptides les plus immunogènes (responsables de 80 à 95 % de l'immunoréactivité des cellules T cœliaques) réagissaient au G12. En revanche, un anticorps largement utilisé dans la détection du gluten, R5, ne reconnaissait qu'environ 25 % de ces peptides immunogènes d'une bière d'orge. La corrélation entre la réactivité du G12 et l'immunogénicité des cellules T a été largement étudiée dans plusieurs denrées alimentaires difficiles à analyser, telles que les variétés pures d'avoine ou d'orge (Comino et al., 2011, Comino et al., 2012).
L'avoine est-elle sans danger pour les patients atteints de la maladie cœliaque ? Est-elle réellement exempte de gluten ?
L'avoine est souvent sujette à une contamination croisée (dans les champs et/ou au cours du processus de fabrication). Toutefois, même si l'avoine a été cultivée et traitée avec soin, cela ne signifie pas qu'elle est toujours considérée comme un aliment sans gluten. Une étude réalisée en 2011 (Comino et al., 2011) a montré que toutes les avoines n'ont pas la même teneur en peptides immunogènes du gluten. Toutes les variétés d'avoine contiennent de l'avénine, mais chacune avec une séquence et une structure différentes, et seules certaines de ces variétés peuvent présenter un risque pour les patients cœliaques. Le gluten des variétés d'avoine a été exposé à des cellules de patients cœliaques, et les cellules ont réagi de manière appropriée ; elles n'ont réagi qu'aux variétés d'avoine potentiellement immunotoxiques. Par conséquent, l'anticorps G12 est le meilleur choix pour toute entreprise qui travaille avec de l'avoine sans gluten. D'autres études (Real et al., 2012 ; Comino et al., 2016, Silano et al., 2013) ont permis de mieux caractériser les différences entre ces avoines et leur immunogénicité. Dans tous les cas, le gluten de blé présentait toujours une réactivité au G12 au moins 40 fois supérieure à celle de la variété d'avoine la plus réactive. Peut-être que seuls les patients coeliaques les plus sensibles peuvent être affectés par les variétés d'avoine les plus réactives. De futures études permettront de déterminer le seuil d'avoine contenant des peptides immunogènes du gluten pour avoir un impact sur la santé des personnes atteintes de la maladie cœliaque.
Un patient cœliaque suit un régime sans gluten. Existe-t-il un moyen simple de savoir s'il le fait correctement ?
Jusqu'à récemment, la seule façon d'évaluer l'adhésion à un régime sans gluten était une biopsie, qui est coûteuse, invasive et dégoûtante, ou un test sérologique, qui, selon plusieurs études, n'est pas assez précis (Kaukinen et al., 2002 ; Tursi et al., 2003 ; Moreno et al., 2015 ; Comino et al., 2016) et peut souvent conduire à des faux positifs ou négatifs. Lorsque le gluten est ingéré et atteint le tractus gastro-intestinal, il est décomposé en morceaux plus petits, appelés peptides, et finalement en acides aminés. Certains de ces peptides (comme le 33-mer) résistent à cette digestion et restent intacts. Ils passent la barrière des muqueuses et, chez les patients cœliaques, déclenchent la réponse cœliaque. Ces peptides sont ensuite excrétés dans l'urine et les fèces et leur détection dans ces deux types d'échantillons constitue une preuve directe de l'ingestion de gluten. Une étude récente portant sur 188 patients atteints de la maladie cœliaque a montré qu'environ 40 % d'entre eux présentaient des niveaux détectables de peptides de gluten dans leurs matières fécales. Cette étude a utilisé l'anticorps G12 de Hygiena pour détecter les peptides de gluten.
- "Diversité de l'immunogénicité potentielle de l'avoine : base pour la sélection de variétés d'avoine sans toxicité dans la maladie cœliaque". Comino I, Real A, de Lorenzo L, Cornell H, López-Casado MÁ, Barro F, Lorite P, Torres MI, CebollaA, Sousa C. Gut 2011 Jul;60(7):915-22.
- "Caractérisation moléculaire et immunologique des protéines de gluten isolées à partir de cultivars d'avoine qui diffèrent en termes de toxicité pour la maladie cœliaque". Real A, Comino I, de Lorenzo L, Merchán F, Gil-Humanes J, Giménez MJ, López-Casado MÁ, Torres MI, Cebolla Á, Sousa C, Barro F, Pistón F. PLoS One 2012;7(12):e48365.
- "Identification et caractérisation moléculaire des peptides d'avoine impliqués dans la réponse immunitaire cœliaque". Comino I, Bernardo D, Bancel E, de Lourdes Moreno M, Sánchez B, Barro F, Šuligoj T, Ciclitira PJ,Cebolla Á, Knight SC, Branlard G, Sousa C. Food Nutr Res. 2016 Feb 5;60:30324.
- "Détection sensible des fractions céréalières toxiques pour les patients atteints de la maladie cœliaque à l'aide d'anticorps monoclonaux dirigés contre un peptide immunogène principal du blé". Morón B, Cebolla A, Manyani H, Alvarez-Maqueda M, Megías M, Thomas Mdel C, López MC, Sousa C. Food Nutr Res. 2008 Feb;87(2):405-14.
- "Toward the assessment of food toxicity for celiac patients : characterization of monoclonal antibodies to a main immunogenic gluten peptide". Morón B, Bethune MT, Comino I, Manyani H, Ferragud M, López MC, Cebolla A, Khosla C, Sousa C. PLoS One. 2008 May 28;3(5):e2294. doi : 10.1371.
- "Significant differences in coeliac immunotoxicity of barley varieties" (Différences significatives dans l'immunotoxicité cœliaque des variétés d'orge). Comino I, Real A, Gil-Humanes J, Pistón F, de Lorenzo L, Moreno Mde L, López-Casado MÁ, Lorite P, Cebolla A, Torres MI, Barro F, Sousa C. Mol Nutr Food Res. 2012 Nov;56(11):1697-707.